Абстракт
Приблизительно 5-10% злокачественных опухолей кожи локализуются в периокулярной зоне. Наиболее частой гистологической формой злокачественных периокулярных опухолей является базально-клеточный рак, за ним следуют плоскоклеточный рак, карцинома сальных желез и меланома. Немеланоцитарные опухоли кожи периокулярной области часто вызывают обезображивание лица, разрушая мягкие конъюнктивальные ткани. Для снижения частоты осложнений и летальных исходов при данных поражениях было разработано множество методов лечения. Золотым стандартом лечения периокулярного базально-клеточного и плоскоклеточного рака является эксцизия с исследованием замороженных срезов или микрографическая операция по методу Моса. Тем не менее, эти методы лечения характеризуются наличием различных лимитирующих факторов и необходимостью последующих пластических операций. Химиотерапевтические вещества, содержащиеся в креме КурадермBEC5 и именуемые соласодиновыми рамнозидами, оказывают специфическое воздействие на злокачественные немеланоцитарные опухоли кожи, характеризуются хорошим эффектом, безопасностью и отличными косметическими результатами. Механизм их действия в отношении опухолевых клеток заключается в индукции апоптоза. В данной статье представлены данные, свидетельствующие о то, что КурадермBEC5 эффективен при периокулярном базально-клеточном и плоскоклеточном раке, при этом его применение характеризуется впечатляющими косметическими результатами и не требует пластических операций.
1. Введение
К двум наиболее распространенным в популяции злокачественным опухолях кожи периорбитальной области относятся базально-клеточный рак и плоскоклеточный рак. Базально-клеточный рак является медленно растущей эпидермальной опухолью кожи, развивающейся из базального слоя, имеющей склонность к локальной инвазии и способной вызывать значимые осложнения [1, 2]. Базально-клеточный рак – наиболее распространенная в европеоидной расе опухоль, при этом рост заболеваемости данной патологией настораживает. По статистическим данным в США базально-клеточный рак ежегодно диагностируется у 2,8 миллионов людей [3, 4].
Плоскоклеточный рак – злокачественная опухоль, развивающаяся из ороговевающих клеток эпидермиса и придатков кожи. Он характеризуется локальной инвазией и способностью метастазировать в другие органы организма.
По распространенности в популяции плоскоклеточный рак занимает второе место среди всех злокачественных опухолей кожи. В США ежегодно диагностируется 700000 случаев плоскоклеточного рака.
Базально-клеточный рак и плоскоклеточный рак относятся к немеланоцитарным злокачественным опухолям кожи. За последние три десятилетия распространенность опухолей кожи в популяции превысила распространенность злокачественных опухолей других локализаций, взятых всех вместе [6]. Согласно прогнозу в США в 2012 году ожидается 3010 летальных исходов в связи с немеланоцитарными злокачественными опухолями кожи [7].
Злокачественные опухоли кожи головы и шеи зачастую локализуются в периорбитальной области. Они отграничены медиально — областью носа, латерально — краем глазницы, сверху – надбровной дугой, снизу – нижним краем глазницы.
Базально-клеточный рак составляет 80-95% от всех злокачественных опухолей периокулярной локализации, а плоскоклеточный рак – 5-10% [8].
Золотым стандартом лечения периокулярного базально-клеточного и плоскоклеточного рака является эксцизия опухоли или микрографическая операция по методу Моса. После полного иссечения опухоли обычно требуется пластическая операция.
Коррекция дефектов после эксцизии злокачественных периорбитальных опухолей кожи может быть сопряжена с определенными сложностями для пластических и челюстно-лицевых хирургов. Вследствие анатомических особенностей данной зоны для предотвращения послеоперационных функциональных и эстетических осложнений при выполнении пластических операций необходима высокая точность. Эксцизия периорбитальной опухоли также может быть технически сложной и приводить к косметическим и функциональным нарушениям [8]. Более того, не всегда удается выполнить хирургическое лечение периокулярных злокачественных опухолей.
Локальное лечение базально-клеточного и плоскоклеточного рака различных локализаций и размеров (от нескольких миллиметров до нескольких сантиметров) с помощью крема КурадермBEC5, содержащего соласодиновые рамнозиды, позволяет добиться хороших результатов [9, 10]. Более того, отличительной особенностью лечения с помощью КурадермаBEC5 является отличный косметический результат, характеризующийся формированием малозаметного рубца или отсутствием рубца вовсе [9-17]. Данный метод лечения позволяет сохранять ткани и функциональность органа или области [18].
В данной статье представлен обзор результатов лечения пациентов с базально-клеточным и плоскоклеточным раком периорбитальной области с помощью местных аппликаций КурадермаBEC5. Опухоли данной анатомической зоны считаются сложными для лечения любыми методами.
2. Проведенное лечение
Выбор испытуемых: для данного обзора были отобраны пациенты исключительно с немеланоцитарными злокачественными опухолями периокулярной области. У семи пациентов был диагностирован базально-клеточный рак, а у двух – плоскоклеточный рак. Границы опухоли были следующими: медиально – край носа, латерально – глазничный край, сверху – надбровная дуга, снизу – нижний край глазницы. Пациентом было проведено лечение с помощью локальных аппликаций КурадермаBEC5.
3. BEC – Соласодиновые рамнозиды
Как уже говорилось ранее, Гликоалкалоиды (BEC) получают из плода паслена содомского
(S. sodomaeum), также называемого пасленом Линнея (S. linnaeanum; «чертово яблоко»), и паслена темноплодного (баклажан) [19]. Гликоалкалоиды BEC содержат смесь соласодиновых гликозидов. К ним относятся тригликозиды, такие как соласонин (β-солатриоза) (33%) и соламаргин (β-хакотриоза) (33%), а также ди- и моногликозиды (34%). Все гликозиды содержат одинаковый агликон соласодин [19-24].
4. Крем для местного применения КурадермBEC5
Крем КурадермBEC5 продается в нескольких странах. КурадермBEC5 содержит гликоалкалоиды BEC в концентрации 0,005% и предназначен для местного применения [9, 10].
5. Особенности применения КурадермаBEC5 [25]
При применении препарата следует действовать следующим образом:
— Промыть зону опухоли и окружающий участок кожи с помощью мягкого, не вызывающего раздражения мыла;
— Смыть мыло водой;
— Тщательно высушить кожу;
— Отвинтить крышку тюбика с кремом КурадермBEC5 и удалить защитную пленку, покрывающую выходное отверстие тюбика;
— Нанести крем на опухоль в объеме, необходимом для обработки всей площади опухоли. Крем должен быть распределен равномерно. Не следует наносить большие количества крема и выходить за пределы опухолевой ткани более чем на 0,5 см;
— Для нанесения крема на опухоль необходимо слегка надавить на тюбик;
— После обработки опухоли кремом необходимо наложить окклюзионную повязку (например, бумажная лента), которую не следует удалять до следующего сеанса лечения;
— Препарат следует использовать минимум два раза в стуки, то есть через каждые 12 часов;
— Лечение следует прекратить только после полного очищения кожи от опухоли и замещения дефекта нормальной кожей.
6. Результаты
Клинические данные были подкреплены результатами гистологического исследования биоптатов. В некоторых случаях биопсии были проведены после завершения лечения. Некоторые пациенты отказались от биопсии после завершения лечения по косметическим причинам. Как бы то ни было, все пациенты, кроме одного, который на данный момент все еще находится под наблюдением, были отслежены на протяжении 5 лет. За данный период не было зафиксировано ни одного рецидива.
На Рисунках 1 и 2 представлены результаты клинической и гистологической оценки периокулярного плоскоклеточного рака у пациентов, которым проводилось лечение с помощью препарата КурадермBEC5.
На Рисунках 3 и 9 представлены результаты лечения базально-клеточного рака с помощью препарата КурадермBEC5.
В ходе ответа на лечение с помощью КурадермаBEC5 отмечались следующие изменения: отек, эритема, эрозия, изъязвление области и формирование нормальной ткани.
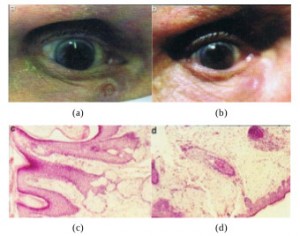
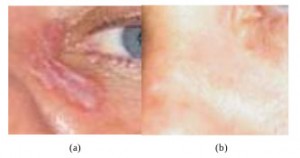
Рисунок 1. Периокулярный плоскоклеточный рак с локализацией в области нижнего века (нижний край глазницы). Внешний вид пациента до (а) и после (b) лечения КурадермомBEC5. После лечения признаки наличия плоскоклеточного рака отсутствовали. Гистологическое исследование подтвердило наличие плоскоклеточного рака до начала лечения (с) и его отсутствие после лечения (d). Длительность курса лечения составила 14 недель. Результаты клинической оценки через 5 лет после завершения лечения свидетельствовали об отсутствии рецидива [16].
В течение 15-30 минут после каждой аппликации препарата пациенты ощущали покалывание или незначительную болезненность области. В начале лечения с помощью КурадермаBEC5 опухоль увеличивалась в размерах. Степень увеличения размеров опухоли, по всей видимости, коррелировала с изначальным объемом опухоли. На данном этапе лечения некоторые пациенты ощущали боль или жжение в течение 15-30 минут после нанесения крема. Через некоторое время на фоне лечения опухоль стала уменьшаться в размерах. Лечение проводилось до тех пор, пока опухоль полностью не исчезла и не была замещена здоровой кожей. После окончания лечения в течение нескольких дней наблюдалась невыраженная эритема.
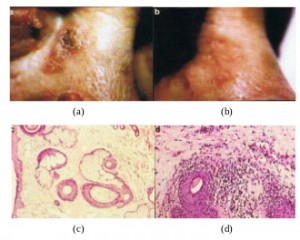
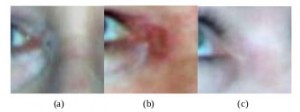
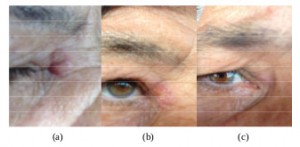
Рисунок 2. Периокулярный плоскоклеточный рак, расположенный на боковой поверхности носа (a). У пациента начали появляться признаки нарушения зрения. После применения КурадермаBEC5 было отмечено исчезновение опухоли (b). После завершения курса лечения зрение восстановилось. Длительность лечения составила 10 недель. Диагноз был подтвержден в ходе гистологического исследования биоптата (с). После завершения лечения в ходе патоморфологического исследования резидуальная опухоль выявлена не была (d). В ходе клинического обследования через 5 лет после лечения кремом Курадерм было подтверждено отсутствие рецидива [16].
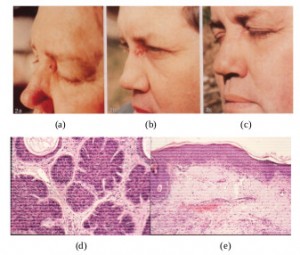
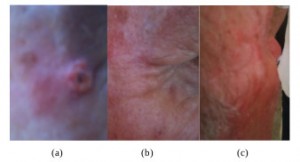
Рисунок 3. Внешний вид пациента с базально-клеточным раком кожи до лечения КурадермомBEC5 (a), и положительная клиническая динамика через две недели после начала лечения (b) и после окончания лечения (с). Длительность лечения составила 5 недель. До (d) и после (e) лечения было проведено гистологическое исследование периокулярной области; при этом было отмечено полное исчезновение опухоли. При обследовании через 5 лет после лечения признаков рецидива выявлено не было [13].
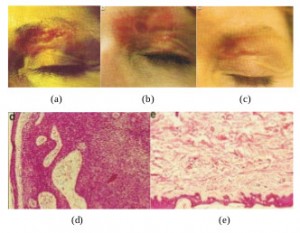
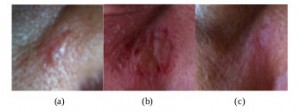
Рисунок 4. Периокулярный базально-клеточный рак верхнего века с вовлечением участка брови. Внешний вид пациента до (а), во время (b) и после (c) лечения кремом КурадермBEC5. Во время лечения опухоль существенно уменьшилась, при этом вокруг резидуальной опухоли наблюдался участок воспалительного изменения кожи. После лечения признаки наличия базальноклеточного рака отсутствовали. При клиническом обследовании через 5 лет после завершения лечения признаки рецидива выявлены не были [16].
Рисунок 5. Периокулярный базально-клеточный рак до (a) и после (b) лечения КурадермомBEC5. Длительность лечения составила 8 недель. Через 5 лет после лечения признаки рецидива отсутствовали [25].
Рисунок 6. Периокулярный базально-клеточный рак. Внешний вид пациента до (а) и после (b, c) лечения КурадермомBEC5. До лечения опухоль возвышалась над поверхностью кожи. После лечения первичную локализацию опухоли установить было невозможно. Длительность лечения равнялась 6 неделям. Через 5 лет после лечения признаков рецидива выявлено не было [25].
Рисунок 7. Периокулярный базально-клеточный рак с поражением боковой поверхности носа. До (а), во время (b) и после (с) лечения КурадермомBEC5. Длительность лечения составила 5 недель. Через 5 лет после лечения признаков рецидива выявлено не было [25].
Рисунок 8. Периокулярный базально-клеточный рак с локализацией в области нижнего века. Внешний вид пациента до (а), во время (b) и после (c) лечения КурадермомBEC5. Длительность лечения составила 4 недели. Через 5 лет после лечения признаки рецидива выявлены не были [25].
Рисунок 9. Периокулярный плоскоклеточный рак с локализацией у боковой поверхности носа. Внешний вид пациента до (а), во время (b) и после (c) лечения КурадермомBEC5. Длительность лечения составила 5 дней. Пациент все еще находится под наблюдением [25].
7. Обсуждение
Злокачественные опухоли кожи подразделяют на две основных группы – немеланоцитарные опухоли и меланома. Базально-клеточный и плоскоклеточный раки кожи относятся к немеланоцитарным злокачественным опухолям кожи и являются наиболее распространенными злокачественными опухолями кожи в популяции. Базально-клеточный рак редко метастазирует или приводит к летальному исходу. Тем не менее, он может вызывать значительное разрушение тканей, изменение внешнего вида и снижение функциональности пораженной области. Плоскоклеточный рак имеет склонность к локальной инвазии и может метастазировать с развитием фатального исхода.
Вероятность развития базально-клеточного рака кожи среди белого населения в США составляет 33%, а в Австралии – 50%. В 80% случаев базально-клеточный рак локализуется в области головы и шеи [6, 7].
Лечение этих немеланоцитарных злокачественных опухолей кожи подбирается врачом с учетом опыта врача, типа, размера, локализации опухоли и количества опухолевых очагов.
Согласно статистическим данным, наиболее эффективным методом лечения является хирургическое иссечение опухоли. Однако в литературе представлены данные о том, что при данном типе лечения частота рецидивов может быть достаточно высокой (30-67%) [26].
За последние несколько десятилетий были разработаны нехирургические методы лечения немеланоцитарных злокачественных опухолей кожи. К этим методам относятся криодеструкция, местные аппликаций фторуроциловой и имиквимодовой мази, лучевая терапия и фотодинамическая терапия. Эти методы целесообразны при лечении немеланоцитарных злокачественных опухолей кожи на ранних стадиях. Тем не менее, они имеют определенные ограничения к использованию и недостатки, такие как необходимость использования местных анестетиков, возможность развития осложнений, дискомфорт и/или болезненность, необходимость многократных посещений врача, вероятность инфицирования, риск образования рубцов, обезображивание лица, длительный период лечения, риск диспигментации, высокая частота рецидивов и возможная необходимость в реконструктивном вмешательстве [25].
Наиболее эффективными методами лечения злокачественных опухолей кожи периокулярной области являются хирургическое иссечение опухоли и микрографическая операция по методу Моса. Пластические операции по поводу дефектов вследствие хирургического иссечения опухоли направлены на сохранение функций, защиту глазного яблока и восстановление эстетического вида лица. Микрографическая операция по методу Моса может быть продолжительной и утомительной для пациента; особенно это актуально в сложных ситуациях, таких как при локализации опухоли в периокулярной области. Кроме того, данная методика требует наличия специально подготовленного дерматолога и ассистента. Многократные инъекции местного анестетика могут сопровождаться ощущением дискомфорта. Операция по методу Моса неэффективна при опухолях с сателлитами и мультицентричном характере роста. Кроме того, хирургические манипуляции являются дорогостоящими.
К сожалению, хирургические вмешательства при злокачественных опухолях периокулярной зоны не всегда выполнимы, а многие пациенты боятся хирургической операции в данной анатомической области. Вследствие этого опухоль увеличивается в размерах и может приводить к неблагоприятным последствиям.
В данной статье представлены доказательства того, что местное лечение базальноклеточного и плоскоклеточного рака периокулярной области с помощью КурадермаBEC5 позволяет добиться впечатляющих результатов.
Выраженный клинический эффект КурадермаBEC5 объясняется противоопухолевым действием соласодиновых рамнозидов (соламаргин и соласонин), содержащихся в препарате. В опухолевых клетках были выявлены специфические эндогенные эндоцитарные лектины [27]. Эти вещества являются белковыми рецепторами, связывающими рамнозу [28]. Данные рецепторы отсутствуют у здоровых клеток [27, 28]. Белковые рецепторы, связывающие рамнозу, способны взаимодействовать с соласодиновыми рамнозидами (BEC). Затем соласодиновые рамнозиды с помощью рецептор-опосредованного эндоцитоза проникают в опухолевые клетки. Соласодиновые рамнозиды взаимодействуют с лизосомами и митохондриями клетки, что приводит к активации внешних и внутренних механизмов апоптоза за счет повышения экспрессии внешних «рецепторов смерти», таких как рецептор к фактору некроза опухолей 1 типа (TNFR-1), Fas-рецептор, домен смерти TNFR-1, домен смерти Fas-рецептора [29, 30]. Соласодиновые рамнозиды увеличивают экспрессию белка Bax и снижают экспрессию белков Bcl-2 и Bcl-x, в результате чего изменяется нормальное соотношение белка Bax к Bcl-2 в клетке. На этом фоне в опухолевых клетках происходит активация каспаз-8, -9 и -3 [24-34], что свидетельствует об активации внешних и внутренних путей апоптоза.
Описанные механизмы позволяют объяснить избирательное действие КурадермаBEC5 на опухолевые клетки. Важным моментом механизма действия Курадерма является то, что во время очищения зоны от опухолевых клеток здоровые клетки оказываются способными замещать их. Эта особенность действия препарата позволяет добиваться великолепных эстетических результатов лечения. Более того, КурадермBEC5 действует на опухолевые клетки вне зависимости от их пролиферативной активности [25].
Клинические исследования показали, что изначально после аппликации крема КурадермBEC5 происходит существенное увеличение размеров опухоли, что объясняется взаимодействием препарата с глубоко расположенными и краевыми опухолевыми клетками, которые обычно не визуализируются невооруженным глазом [15-17, 25]. Со временем при продолжении лечения размеры опухолей уменьшаются за счет исчезновения опухолевых клеток, которые взаимодействовали с препаратом, и их замещения здоровыми клетками. По мере уменьшения размеров опухоли лечение продолжают в более низких дозах до момента полного ее исчезновения и замещения здоровыми клетками кожи [25].
Как уже сообщалось ранее в плацебо контролируемом клиническом исследовании курадерма, болевые ощущения, возникающие у некоторых пациентов во время лечения, могут быть следствием кератолитического действия салициловой кислоты и мочевины, но не кармустина (11, 35, 36).
Лечение препаратом следует прекращать только при полном замещении опухоли здоровыми клетками, что объясняет причину колебаний продолжительности лечения КурадермомBEC5 в зависимости от размеров, локализации и типа опухоли.
Лечение с помощью КурадермаBEC5 значительно отличается от всех других способов воздействия на опухолевые клетки. После применения КурадермаBEC5 отсутствует необходимость в проведении пластических операций, отмечаются естественные процессы заживления без обезображивания пациента, лечебный процесс не уменьшает функциональность тканей [18].
8. Заключение
Применение КурадермаBEC5 с целью лечения злокачественных немеланоцитарных опухолей кожи периокулярной области характеризуется высокой эффективностью и безопасностью. У данного способа лечения отсутствуют недостатки, характерные для других методов лечения. КурадермBEC5 характеризуется специфичностью действия, то есть оказывает влияние только на опухолевые клетки и не затрагивает здоровые клетки, благодаря чему удается добиться прекрасных косметических результатов. После применения препарата не требуется выполнение пластических операций. Данное предварительное исследование свидетельствует о целесообразности проведения дальнейших клинических исследований по оценке эффективности препарата КурадермBEC5 при периокулярных злокачественных опухолях кожи.
Литература
[1] S. J. Miller, “Biology of Basal Cell Carcinoma (Part 1),”
Journal of the American Academy of Dermatology, Vol.
24, No. 1, 1991, pp. 1-13.
[2] A. N. Crowson, “Basal Cell Carcinoma: Biology, Mor-
phology and Clinical Implications,” Modern Pathology,
Vol. 19, No. S2, 2006, pp. 5127-5147.
doi:10.1038/modpathol.3800512
[3] D. L. Miller and M. A. Weinstock, “Nonmelanoma Skin
Cancer in the United States: Incidence,” Journal of the
American Academy of Dermatology, Vol. 30, No. 5, 1994,
pp. 774-778.
[4] D. H. Brewster, L. A. Bhatti, J. H. C. Inglis, E. R. Nairn
and V. R. Doherty, “Recent Trends in Incidence of Non-
melanoma Skin Cancers in the East of Scotland, 1992-
2003,” British Journal of Dermatology, Vol. 156, No. 6,
2007, pp. 1295-1300.
doi:10.1111/j.1365-2133.2007.07892.x
[5] American Academy of Dermatology, “Squamous Cell
Carcinoma,” 2012.
http://www.aad.org/skin-conditions/dermatology-a-to-z/s
quamous-cell-carcinoma
[6] R. S. Stern, “Prevalence of a History of Skin Cancer in
2007: Results of an Incidence-Based Model,” Archives
Dermatology, Vol. 146, No. 3, 2010, pp. 279-282.
doi:10.1001/archdermatol.2010.4
[7] American Cancer Society, “Cancer Facts & Figures,”
2012.
[8] R. I. Ceilley and J. Q. del Rosso, “Current Modalities and
New Advances in the Treatment of Basal Cell Carci-
noma,” International Journal of Dermatology, Vol. 45,
No. 5, 2006, pp. 489-498.
doi:10.1111/j.1365-4632.2006.02673.x
[9] B. E. Cham, “Intralesion and Curaderm BEC5 Topical
Combination Therapies of Solasodine Rhamnosyl Glyco-
sides Derived from the Eggplant or Devil’s Apple Result
in Rapid Removal of Large Skin Cancers. Methods of
Treatment Compared,” International Journal Clinical Me-
dicine, Vol. 3, No. 2, 2012, pp. 115-124.
doi:10.4236/ijcm.2012.32024
[10] B. E. Cham, “Topical Solasodine Rhamnosyl Glycosides
Derived from the Eggplant Treats Large Skin Cancers:
Two Case Reports,” International Journal Clinical Medi-
cine, Vol. 2, No. 4, 2011, pp. 473-477.
doi:10.4236/ijcm.2011.24080
[11] S. Punjabi, L. J. Cook, P. Kersey, R. Marks and R. Cerio,
“Solasodine Glycoalkaloids: A Novel Topical Therapy for Basal Cell Carcinoma.
A Double-Blind, Randomized, Placebo-Controlled, Parallel Group, Multicentre Study,” International Journal Dermatology,
Vol. 47, 2008, pp. 78-82. doi:10.1111/j.1365-4632.2007.03363.x
[12] B. E. Cham and H. M. Meares, “Glycoalkaloids from So-
lanum sodomaeum L. Are Effective in the Treatment of
Skin Cancers in Man,” Cancer Letters, Vol. 36, No. 2,
1987, pp. 111-118. doi:10.1016/0304-3835(87)90081-4
[13] B. E. Cham, B. Daunter and R. Evans, “Topical Treat-
ment of Malignant and Premalignant Skin Cancers by
Very Low Concentrations of a Standard Mixture of So-
lasodine Glycosides,” Cancer Letters, Vol. 59, No. 3,
1991, pp. 183-192. doi:10.1016/0304-3835(91)90140-D
[14] B. E. Cham, “Solasodine Glycosides as Anti-Cancer Agents:
Pre-Clinical and Clinical Studies,” Asia Pacific Journal
Pharmacology, Vol. 9, No. 2, 1994, pp. 113-118.
[15] B. E. Cham, “Solasodine Rhamnosyl Glycosides in a
Cream Formulation Is Effective for Treating Large and
Troublesome Skin Cancers,” Research Journal Biological
Science, Vol. 2, No. 7, 2007, pp. 749-761.
[16] B. E. Cham, “Solasodine Rhamnosyl Glycosides Specifi-
cally Bind Cancer Cell Receptors and Induce Apoptosis
and Necrosis. Treatment for Skin Cancer and Hope for
Internal Cancers,” Research Journal Biological Science,
Vol. 2, No. 7, 2007, pp. 503-514.
[17] T. R. Chase, “CuradermBEC5 for Skin Cancers, Is It? An
Overview,” Journal Cancer Therapy, Vol. 2, No. 5, 2011,
pp. 728-745. doi:10.4236/jct.2011.25099
[18] L. H. Goldberg, J. M. Landau, M. N. Moody and I. J.
Vergilis-Kalner, “Treatment of Bowen’s Disease on the
Penis with Low Concentration of a Standard Mixture of
Solasodine Glycosides and Liquid Nitrogen,” Derma-
tologic Surgery, Vol. 37, 2011, pp. 858-861.
doi:10.1111/j.1524-4725.2011.02014.x
[19] B. E. Cham and L. Wilson, “HPLC of Glycoalkaloids
from Solanum sodomaeum,” Planta Medica, Vol. 53, No.
1, 1987, pp. 34-36. doi:10.1055/s-2006-962612
[20] B. E. Cham, M. Gilliver and L. Wilson, “Antitumour
Effects of Glycoalkaloids Isolated from Solanum sodo-
maeum L.,” Planta Medica, Vol. 53, No. 1, 1987, pp. 34-
36. doi:10.1055/s-2006-962612
[21] B. E. Cham and B. Daunter, “Solasodine Glycosides. Se-
lective Cytotoxicity for Cancer Cells and Inhibition of
Cytotoxicity by Rhamnose in Mice with Sarcoma 180,”
Cancer Letters, Vol. 55, 1990, pp. 221-225.
doi:10.1016/0304-3835(90)90122-E
[22] B. E. Cham and T. R. Chase, “Solasodine Rhamnosyl
Glycosides Cause Apoptosis in Cancer Cells, Do They
Also Prime the Immune System Resulting in Long Term
Protection against Cancer?” Planta Medica, Vol. 78, 2012,
pp. 349-353. doi:10.1055/s-0031-1298149
[23] B. E. Cham, “Monograph on the Compound BEC,” Drugs
of the Future, Vol. 13, 1988, pp. 714-716.
[24] B. E. Cham, “The Eggplant Cancer Cure. A Treatment for
Skin Cancer and New Hope for Other Cancers from Na-
ture’s Pharmacy,” Smart Publications, Petaluma, 2007, pp. 1-122.
[25] B. E. Cham, “Inspired by Nature, Proven by Science. The
New Generation Cancer Treatment That Causes Cancer
Cells to Commit Suicide,” in Preparation.
[26] L. A. E. Sussman and D. F. Liggins, “Incompletely Ex-
cised Basal Cell Carcinoma a Management Dilemma?”
Aust NZ Journal Surgery, Vol. 66, 1996, pp. 276-278.
doi:10.1111/j.1445-2197.1996.tb01184.x
[27] B. Daunter and B. E. Cham, “Solasodine Glycosides, in
Vitro Preferential Cytotoxicity for Human Cancer Cells,”
Cancer Letters, Vol. 55, No. 3, 1990, pp. 209-220.
doi:10.1016/0304-3835(90)90121-D
[28] R. J. Lipscombe, S. J. Carter and M. Ruane, “Rhamnose
Binding Protein,” United States Patent 6, 930, 171 B2,
2005.
[29] L. Y. Shiu, L. C. Chang, C. H. Liang, Y. S. Huang, H. M.
Sheu and K. W. Kuo, “Solamargine Induces Apoptosis
and Sensitizes Breast Cancer Cells to Cisplatin,” Food
Chemical Toxicology, Vol. 45, No. 11, 2007, pp. 2155-
2164. doi:10.1016/j.fct.2007.05.009
[30] C. H. Liang, L. Y. Shiu, L. C. Chang, H. M. Sheu and K.
W. Kuo, “Solamargine Upregulation of Fas, Downregula-
tion of HER 2, and Enhancement of Cytotoxicity Using
Epirubicin in NSCLC Cells,” Molecular Nutrition Food
Research, Vol. 51, 2007, pp. 999-1005.
doi:10.1002/mnfr.200700044
[31] L. Y. Shiu, C. H. Liang, L. C. Chang, H. M. Sheu, E. M.
Tsai and K. W. Kuo, “Solamargine Induces Apoptosis
and Enhances Susceptibility to Trastazumab and Epirubi-
cin in Breast Cancer Cells with Low or High Expression
Levels of HER2/neu,”Bioscience Reports, Vol. 29, No. 1,
2009, pp. 35-45. doi:10.1042/BSR20080028
[32] L. Sun, Y. Zhao, X. Li, H. Yuan, A. Cheng and H. Lou,
“A Lysosomal-Mitochondrial Death Pathway Is Induced
by Solamargine in Human K562 Leukemia Cells,” Toxi-
cology in Vitro, Vol. 24, No. 6, 2010, pp. 1504-1511.
doi:10.1016/j.tiv.2010.07.013
[33] L. Sun, Y. Zhao, H. Yuan, X. Li, A. Cheng and H. Lou,
“Solamargine, a Steroidal Alkaloid Glycoside, Induces
Oncosis in Human K562 Leukemia and Squamous Cell
Carcinoma KB Cells,” Cancer Chemotherapy Pharma-
cology, Vol. 65, No. 4, 2010, pp. 1125-1130.
[34] X. Li, Y. Zhao, W. K. K. Wu, S. Liu, M. Cui and H. Lou,
“Solamargine Induces Apoptosis Associated with p53
Transcription-Dependent and Transcription-Independent
Pathways in Human Osteosarcoma U20S Cells,” Life Sci-
ence, Vol. 88, No. 7-8, 2011, pp. 314-321.
[35] B. E. Cham, “Solasodine Glycosides: A Topical Therapy
for Actinic Keratosis. A Single-Blind, Randomized, Pla-
cebo-Controlled, Parallel Group Study,” Journal Cancer
Therapy, Vol. 4, No. 2, 2013, pp. 588-596.
doi:10.4236/jct.2013.42076
[36] B. E. Cham, “Drug Therapy: Solamargine and Other So-
lasodine Rhamnosyl Glycosides as Anticancer Agents,”
Modern Chemotherapy, Vol. 2, No. 2, 2013, pp. 33-49.
doi:10.4236/mc.2013.22005
Copyright © 2013 Bill E. Cham. This is an open access article distributed under the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.